کروماتوگرافی میل ترکیبی چیست؟ – به زبان ساده
کروماتوگرافی میل ترکیبی روشی آزمایشگاهی برای جدا کردن مولکولهای مخلوط شیمیایی از یکدیگر است. در این روش از برهمکنش بین مولکول مورد نظر و بستر استفاده میشود تا براساس تفاوت زمان خروج آنها از ستون کروماتوگرافی، مولکول هدف از سایر مولکولهای موجود در نمونه جدا شود. در ادامه کروماتوگرافی میلترکیبی، کاربرد آن و همچنین مشکلات احتمالی در حین انجام این روش و راهحلهای مربوط به آن توضیح داده میشوند.
- خواهید آموخت چگونه مولکولهای هدف را با کروماتوگرافی میل ترکیبی جداسازی کنید.
- نقش فاز ساکن، متحرک و لیگاند در خلوص نمونه را خواهید شناخت.
- مراحل عملی نصب ستون، شستشو و جمعآوری نمونه را میآموزید.
- نحوه انتخاب روش اجرایی و بکارگیری ابزارهای عملی را یاد میگیرید.
- میآموزید چگونه با مشکلات رایج در جداسازی و پیک خروجی برخورد کنید.
- بر ارزیابی مزایا، محدودیتها و کاربردهای تخصصی این تکنیک مسلط میشوید.
کروماتوگرافی میل ترکیبی چیست ؟
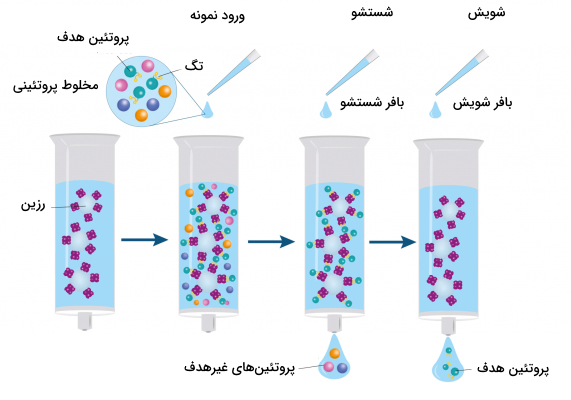
در روش جداسازی «کروماتوگرافی میل ترکیبی» (Affinity Chromatography)، مولکولهای هدف که درون فاز متحرک حل شدهاند با برهمکنشهای برگشتپذیر به لیگاند (فاز ساکن) متصل میشوند و از سایر مولکولهای موجود در محلول جدا میشوند.
این برهمکنشهای برگشتپذیر میتوانند «زیستی» (Biospecific) یا «غیرزیستی» (Nonbiospecific) باشند. اتصال آنتیبادی به پروتئین A یا اتصال هورمون به گیرندهاش واکنش زیستی و اتصال پروتئین به سوبسترا رنگی اتصال غیرزیستی است. جدول زیر نشاندهنده برهمکنشهایی است که معمولا در کروماتوگرافی میلترکیبی برای جداسازی مولکول هدف از سایر ترکیبات موجود در نمونه استفاده میشود.
| لیگاند | مولکول هدف |
| سوبسترا مکمل | آنزیم |
| آنتیبادی | آنتیژن |
| لکتین | پلیساکارید |
| نوکلئیکاسید | توالی نوکلئوتیدی مکمل |
| هورمون | گیرنده یا رسپتور |
| آویدین | بیوتین یا بیوتین متصل به مولکولی دیگر |
| کالمادولین | جفت متصلشونده به کالمادولین |
| گلوتاتیون | پروتئین متصل به GST |
| پروتئین A یا پروتئین G | ایمنوگلوبولین |
| نیکل-NTA | پروتئین متصل به پلیهیستیدین |
فاز ساکن و متحرک در کروماتوگرافی میل ترکیبی
فاز ساکن کروماتوگرافی میل ترکیبی از بخشهای زیر تشکیل شده است.
- ماتریکس یا رزین
- لیگاند
- بازو حدفاصل (گاهی اوقات)
- یون فلزی متصل به لیگاند (گاهی اوقات)
فاز متحرک کروماتوگرافی میل ترکیبی از بخشهای زیر تشکیل شده است.
- محلول اتصالدهنده: محلولی است که باعث اتصال مولکول هدف به لیگاند میشود.
- «محلول شستشو» (Wash): محلولی است که برای مراحل شستشو در ستون به کار میرود.
- «محلول شوینده» (Eluate): محلولی است که باعث جداشدن مولکول هدف از لیگاند میشود.
کروماتوگرافی میل ترکیبی چگونه کار میکند ؟
در کروماتوگرافی میلترکیبی مولکول هدف در نمونه در شرایط مناسب برای اتصال به لیگاند به مولکول مکمل خود متصل میشود. این لیگاندها با پیوند کووالانسی قوی به ماتریکس نامحلول و جامد (معمولا پلیمری مثل آگارز یا پلیآکریلآمید) اتصال پیدا کردهاند. نحوه عملکرد این کروماتوگرافی را میتوان در چند مرحله خلاصه کرد.
- آمادهسازی ستون و اتصال لیگاند مورد نظر به ماتریکسها
- نمونه در فاز متحرک به داخل ستون ریخته میشود.
- مولکولهای هدف به لیگاند اختصاصی خود متصل میشوند ولی سایر مولکولها از ستون خارج میشوند.
- برای اطمینان از خارج شدن سایر مولکولهای موجود در نمونه، ستون با بافر شستشو شسته میشود تا اگر اتصال ضعیفی بین مولکولهای غیرهدف و فاز ساکن برقرار شده است، تخریب شود و تنها مولکولهای هدف در ستون باقی بمانند.
- پس از خروج مولکولهای غیر هدف، محلول شوینده به ستون اضافه میشود تا اتصال بین لیگاند و مولکول هدف را از بین برود و مولکول هدف همراه با محلول شوینده از ستون خارج شود.
- ستون برای استفاده بعدی آماده میشود.
چه زمانی از کروماتوگرافی میل ترکیبی استفاده میشود ؟
به دلیل اختصاصیت بالای این نوع کروماتوگرافی، معمولا برای خالصسازیهای تکمرحلهای استفاده میشود. مثالهایی از کاربردهای این نوع کروماتوگرافی در بخش زیر آمده است.
- جداسازی اجزای مختلف محلول
- حذف ناخالصیها
- شناسایی سوبسترا در واکنشهای آنزیمی
- مطالعه جایگاه فعال آنزیم
- مطالعه برهمکنش بین آنتیبادی و آنتیژن
- شناسایی «چندریختی تکنوکلئوتیدی» (Single Nucleotide Polymorphisms) و جهش در نوکلئیک اسید
مزایا و معایب کروماتوگرافی میل ترکیبی چیست ؟
از آنجا که کروماتوگرافی میل ترکیبی وابسته به برهمکنش میان مولکولهای مواد مختلف است اختصاصیت بالایی ایجاد میکند. مزایا و معایب این روش در بخش زیر توضیح داده شدهاند.
مزایای استفاده از کروماتوگرافی میل ترکیبی
مزایای این روش شامل موارد زیر است.
- جداسازی مولکول هدف به طور اختصاصی
- خالصسازی سریع در یک مرحله
- امکان استفاده دوباره از ماتریکس
معایب استفاده از کروماتوگرافی میل ترکیبی
با این وجود که کروماتوگرافی میل ترکیبی میتواند مولکول مورد نظر را به طور اختصاصی از سایر مولکولهای موجود در نمونه در یک مرحله جدا کند، معایبی هم دارد که در بخش زیر مشخص شدهاند.
- زمانبر بودن
- گران بودن
- نیازمند مهارت
- بازدهی نسبتا پایین
- امکان تخریب رزین
انواع مختلف کروماتوگرافی میل ترکیبی
کروماتوگرافی میل ترکیبی در آزمایشگاه به صورت زیر مورد استفاده قرار میگیرد.
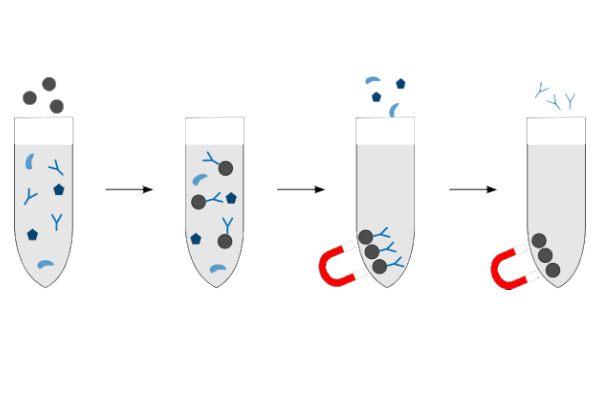
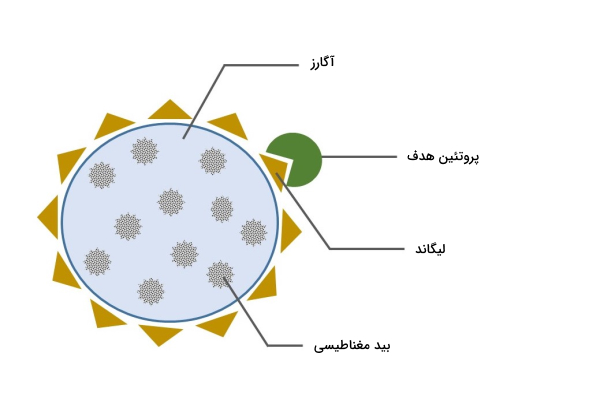
- «بیدهای مغناطیسی» (Magnetic Beads): در این روش لیگاند به بیدهای مغناطیسی متصل میشود. پس از ریختن نمونه روی لیگاند مولکول هدف به لیگاند متصل میشود. با یک آهنربا لیگاند و مولکول هدف متصل به آن در یک ناحیه ثابت میمانند و سایر مواد به راحتی جدا میشوند. بعد از جدا شدن سایر مولکولها از بافر شوینده استفاده میشود و مولکولهای هدف از لیگاند خود روی بید جدا میشوند.
- «کروماتوگرافی مایع با عملکرد سریع» (Fast Protein Liquid Chromatography | FPLC): دستگاهی برای جداسازی پروتئینها به روش کروماتوگرافی میل ترکیبی است که فشار حرکت بافرها در ستون توسط دستگاه کنترل میشود. این روش تکرارپذیری آزمایش را بالا میبرد ولی نیازمند خرید تجهیزات گرانقیمت است.

- «کانالهای چکهای» (Drip Columns): در این روش مواد داخل ستون پلاستیکی یکبار مصرف قرار داده میشوند. تمام فرایند به روش دستی انجام میشود و با استفاده از نیروی گرانش (بدون فشار پمپ) مواد از داخل ستون قطره قطره به بیرون میآیند.
- «کروماتوگرافی به شیوه بچ» (Batch Chromatography): در این روش نمونه و رزین داخل یک ظرف قرار داده میشوند. سپس سانتریفیوژ میشوند. لیگاند متصل به ماتریکس به همراه مولکول هدف تهنشین میشوند و سایر مواد را از روی رسوب خارج میکنند.
اهمیت نحوه اتصال لیگاند روی ماتریکس
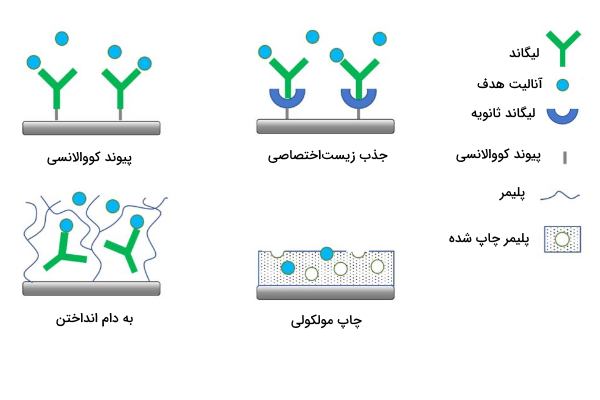
روشهای مختلفی برای ثابتنگه داشتن لیگاند روی ماتریکسهای کروماتوگرافی تا به امروز ابداع شده است که بخشی از آنها را در تصویر زیر میبینید. انتخاب این که از چه روشی برای ثابت کردن لیگاند استفاده شود یک عامل مهم در هنگام تهیه ستون در نظر گرفته میشود. چون جهتگیری غیرصحیح لیگاند و موانع فضایی موجب کاهش اتصال سوبسترا به لیگاند میشود و بازدهی ستون را کاهش میدهد.
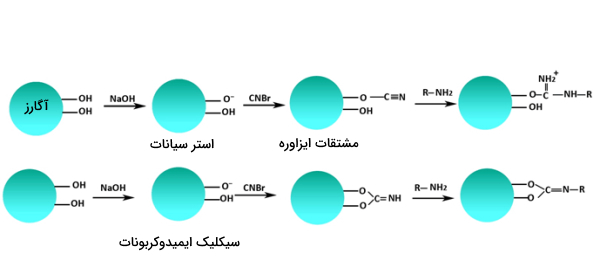
اتصال از طریق پیوند کووالانسی
ثابت کردن لیگاند با استفاده از پیوند کووالانسی یکی از پرکاربردترین روشهای ثابتسازی است و به چندین روش استفاده میشود. یکی از رایجترین آنها استفاده از «سیانوژن برماید» (CNBr) است. در این روش گروههای هیدروکسیل موجود بر ماتریکس تغییر داده میشوند تا «استر سیانات» (Cyanate Ester) فعال یا گروه «ایمیدوکربونات» (Imidocarbonate) روی آنها ایجاد شود. این گروهها میتوانند با آمینهای اولیه روی لیگاند پیوند ایزاوره ایجاد کنند و لیگاند را ثابت نگه دارند.
لیگاندها همچنین میتوانند با گروههای آمین خود به گروههای «کربونیلایمیدازول» (Carbonyldiimidazole) یا «N هیدروکسیسوکسینات» (N-Hydroxysuccinimide) موجود در سطح ماتریکسها متصل شوند.
روشدیگری که برای اتصال کووالانسی بین لیگاند و ماتریکس استفاده میشود روش «آمیناسیون کاهشی» (Reductive Amination) یا «شیف» (Schiff Base) است. در این روش از گروههای عاملی هیدروکسیل یا کربوکسیل برای برقراری پیوند کووالانسی استفاده میشوند.
اتصال لیگاند در جهت نامناسب یا از طریق چندین بخش به ماتریکس نیز میتواند در اثر گروههای نسبتا مشابه موجود روی لیگاند (برای مثال انواع گروه آمین) صورت بگیرد. برای جلوگیری از این اتفاق اتصال با گروههای اختصاصیتر مثل گروههای سولفیدریل استفاده میشوند. از گروههای کربونات که در نواحی خاصی از گلیکوپروتئینها یا آنتیبادیها قرار دارند نیز میتوان به این منظور استفاده کرد. این گروهها ابتدا توسط «پریدات» ( Periodate) اکسید میشوند یا با استفاده از آنزیمهای خاصی تشکیل گروه آلدهید میدهند. سپس لیگاند با استفاده از این گروههای عاملی به ماتریکس دارای گروههای آمین یا «هیدرازید» (hydrazide) متصل میشود.
اتصال از طریق پیوند غیرکووالانسی
لیگاندها می توانند از طریق پیوندهای غیرکووالانسی نیز به ماتریکس متصل شوند. این اتصال از طریق «جذب فیزیکی» (Physical Adsorption) لیگاند به ماتریکس یا از طریق برهمکنشهای هیدروژنی، الکترواستاتیک یا هیدروفوب صورت میگیرد. با وجود این که اتصال ماتریکس با این روش بسیار ساده است ولی پایداری کم این پیوندها یا اتصال از جهت نامناسب لیگاند به ماتریکس از معایب آن است.
اتصالات زیستاختصاصی یکی از روشهای اتصال غیرکووالان است. برای مثال پپتیدها یا پروتئینهای دارای تگ بیوتین میتوانند به ماتریکس دارای «آویدین» (Avidin) یا «استرپآویدین» (Streptavidin) متصل شوند.
مثالی دیگر از روشهای غیرکووالان تکنیک به دام انداختن است که در آن لیگاند توسط پلیمرهای آلی احاطه میشود. برای مثال پروتئین BSA را میتوان با ایجاد پیوندهای واسطه با گلوترآلدهید به دام انداخت.
اتصال از طریق چاپ مولکولی
در روش چاپ مولکولی ماتریکس دارای پاکتهای پیوندی است که مانند لیگاند برای مولکولهای خاص عمل میکند. یک روش برای ساخت این ماتریکسها، ترکیب کردن مولکول هدف با مونومرهایی دارای گروه عملکردی با مولکول هدف، است. بعد از پلیمریزاسیون این مونومرها مولکول هدف از آنها جدا میشود و محفظههای خالی برای اتصال به مولکول هدف ایجاد میشود. از این محفظهها میتوان برای به دامانداختن مولکول هدف و جدا کردن آن از ترکیبهایی که حاوی مولکولهای دیگر استفاده کرد.
نکات استفاده از کروماتوگرافی میل ترکیبی
برای جداسازی مولکول هدف با استفاده از کروماتوگرافی میل ترکیبی باید به مواردی همچون نوع ماتریکس، بافرها، سرعت جریان محلول و غیره توجه کرد. در ادامه نکات مورد توجه در برای بهینهکردن جداسازی مولکول هدف در کروماتوگرافی میلترکیبی ارائه میشوند.
انتخاب ماتریکس
ماتریکس مناسب برای این نوع کروماتوگرافی باید دارای شرایط زیر باشد.
- آبدوستی: از ایجاد اتصالات غیر اختصاصی جلوگیری میکند.
- منافذ بزرگ: این کار سطح مورد نیاز برای اتصال مولکول هدف را فراهم میکند.
- استحکام: ماتریکس باید در مقابل فشار جریان محلول مقاومت داشته باشد.
- خنثی بودن: ماتریکس نباید به جداشدن کمک کند.
- پایداری شیمیایی: ماتریکس باید در برابر تمام محلولهایی که در کروماتوگرافی استفاده میشوند، پایدار باشد.
برخی از ماتریکسهای رایج مورد استفاده در کروماتوگرافی میل ترکیبی در ادامه توضیح داده شدهاند.
- آگارز:
- آبدوست
- تقریبا اتصال غیراختصاصی ندارد.
- مناسب خالصسازی پروتئینها
- قیمت مناسب
- ژل سیلیکون:
- دارای منافذ ریز (افزایش اتصال غیراختصاصی)
- عملکرد از طریق گروه عاملی سیالان (silane)
- شستهشدن سیالانها با محلول بازی (کاهش پایداری)
- آلومینیوم اکسید:
- سطح اسیدی
- اتصال برگشتناپذیر به آمینها
- استفاده جهت کاهش تعداد سوبسترای خاص
- آکریلات:
- نسبتا آبگریز (احتمال وجود اتصال غیراختصاصی)
- ذرات تکسایز
- استفاده جداسازی سلولها
- پلیمرهای آلی:
- نسبتا آبگریز (احتمال وجود اتصال غیراختصاصی)
- ذرات تکسایز
- استفاده برای اتصال لیگاند
- برای جداسازی پروتئین به دلیل وجود اتصالات غیراختصاصی توصیه نمیشود.
بافر
بافری که برای کروماتوگرافی میل ترکیبی استفاده میشود یکی از مهمترین فاکتورها برای جداسازی مولکولها است. بافر نباید نمونه را تجزیه کند اما گاهی لازم است که از حلالهای دناتورهکننده استفاده کنیم.
برای مثال جدا کردن آنتیبادی از آنتیژن با استفاده از بافرهای «کاتروپیک» (Chaotropic) قوی یا در pH بسیار پایین انجام میگیرد. برای اینکه این حلالهای قوی آنتیژن و آنتیبادی را تخریب نکنند، بهتر است در ظروف جمعآوری محتویات خارج شده از ستون از باز «تریس» (Tris) به صورت خشک استفاده شود. این باز به سرعت pH محلول را به حالت طبیعی برمیگرداند.
نکته دیگری که در انتخاب بافرهای شوینده اهمیت دارد عدم استفاده از بافری است که نزدیک یا در محدوده pI نمونه داشته باشد. در این شرایط نمونه داخل ستون رسوب نمیکند و راحت از ستون جدا میشود.
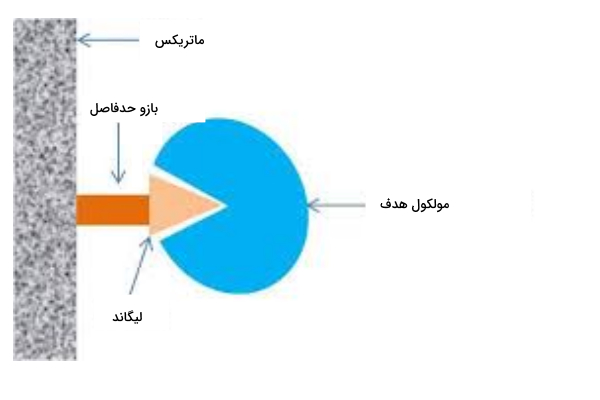
بازو حدفاصل
استفاده کردن یا نکردن از بازو حدفاصل بین لیگاند و ماتریکس به عواملی همچون لیگاند، مولکول هدف و نوع اتصال بستگی دارد. بازوحدفاصل برای ایجاد فاصله بین ماتریکس و لیگاند استفاده میشود. اگر لیگاند بزرگ و مولکول هدف کوچک باشد، نیازی به استفاده از بازو حدفاصل نیست.
| لیگاند | پروتئین | بهترین بازو حدفاصل |
| کوچک | کوچک | کوتاه |
| کوچک | بزرگ | بلند |
| بزرگ | کوچک | نیازی نیست. |
| بزرگ | بزرگ | نیازی نیست. |
اگر مولکول نمونه وزن مولکولی زیادی داشته باشد بهتر است که برای جلوگیری از ممانعت فضایی از بازوحدفاصل میان ماتریکس و لیگاند استفاده شود. جدول بالا شرایط استفاده از بازوی حدفاصل را توضیح داده است.
بازوهای حدفاصل اندازههای متفاوتی دارند ولی بهتر است که برای شروع از بازوهایی حدود 6 کربن استفاده شود. بازوهایی با تعداد کربن کمتر انعطافپذیری لازم را به لیگاند نمیدهند. بازوهای حدفاصل رایج در جدول زیر مشخص شدهاند.
| بازو حدفاصل | طول زنجیره |
| سیانوژن بروماید | C1 |
| اپوکسید (Epoxide) | C3 |
| اپوکسید 6 کربنه اسیدی | C10 |
| دیامین (Diamine) | C10 |
آمادهسازی ژل
ابتدا میزانی از ژل (رزین) که لازم است درون ستون متراکم شود را بررسی کنید. سپس حجم را از طریق فرمول زیر محاسبه کنید.
(کل نمونه/ واحدهای نمونه) × حجم ژل در هر واحد نمونه
نتیجهای که از این فرمول بدست میآید باید در 2-3 ضرب شود تا میزان واقعی ژل مورد نیاز محاسبه شود. برای مثال اگر 1 ml از پروتئین-A به 20 mg از IgG متصل میشود و حجم نمونه شما 40 mg باشد، حجم کل را (40 mg) تقسیم بر ظرفیت ژل (20 mg) میکنیم. سپس نتیجه را در حجم ژل (1 ml) ضرب میکنیم. در نهایت این نتیجه را در 2 یا 3 ضرب میکنیم تا حجم نهایی ژل بدست آید. در اینجا نتیجه 4 تا 6 ml محاسبه میشود.
اگر از رزینهای از پیش آبگرفته استفاده میکنید نیازی به این مراحل نیست و تنها رزین به شستشو نیاز دارد. استفاده از حجمی در حدود 200 به 1 (بافر به ژل) برای شستشوی ژل، معمولا به خوبی جواب میدهد. برای شستشوی ژل میتوانید از آب مقطر یا بافر متعادلسازی استفاده کنید.
اتصال لیگاند به ماتریکس
به صورت یک قانون کلی برای اتصال لیگاند به ماتریکس برای مولکولهایی با سایز متوسط (50 KDa) باید از غلظت 10 mg لیگاند در هر میلیلیتر از ژل استفاده کرد. برای اتصال مولکولهای بزرگتری مثل IgG، از غلظت 5 mg/ml یا IgM از 1 mg/ml استفاده میشود.
برای ترکیب کردن لیگاند و ماتریکس به جای استفاده از همزنهای آهنربایی از حرکات دورانی استفاده کنید. چون این آهنرباها به ماتریکس آسیب میزنند.
میزان حجم بافر اتصالدهنده (همراه لیگاند) نیز حدودا باید دو برابر حجم ماتریکس ژلی باشد. زمان اتصال حدود 2 ساعت در دمای اتاق و تا 16 ساعت در دمای 4 درجه سانتیگراد در نظر گرفته میشود. اتصال لیگاند به ماتریکس میتواند به صورت یکنقطهای یا چندنقطهای انجام شود.
- اتصال تکنقطهای انعطافپذیری خوبی به لیگاند میدهد و دسترسی مولکول هدف به جایگاهفعال را بیشتر میکند.
- اتصال چندنقطهای اتصال قویتری از لیگاند به ماتریکس میدهد و نشت لیگاند را در حین انجام فرایند کروماتوگرافی کاهش میدهد. اما ممکن است در حین انجام اتصال جایگاه فعال برخی لیگاندها مسدود شود.
بررسی بازده اتصال لیگاند به ماتریکس
میزان لیگاندهای متصل شده به ماتریکس کیفیت جداسازی و میزان مولکول هدفی که میتوانیم به وسیله کروماتوگرافی بدست آوریم را نشان میدهد. برای بررسی میزان لیگاندهای متصل شده به ماتریکس از روشهای زیر استفاده میشود.
- اندازهگیری میزان جذب UV ماتریکسهای موجود در محلول قبل و بعد از تماس با ماتریکس.
- جذب در 280 نانومتر برای لیگاندهای پلیپپتیدی به خوبی عمل میکند. برای گروههای هم از جذب در 405 نانومتر استفاده میشود. البته این روش تنها وقتی میزان زیادی از لیگاند موجود باشد، استفاده میشود.
- استفاده از روشهای رنگسنجی
- استفاده از روشهای شناسایی با استفاده از نشانگر فلورسنتی (از روش رنگسنجی دقیقتر است.)
- حل کردن بخشی از ژل که حاوی لیگاند است و انجام تست بررسی پروتئین، آنالیز یا بررسی میزان کلی نیتروژن روی ژل
- انجام تست فعالیت (روی بخش کوچکی از ژل اتصال لیگاند به ماتریکس بررسی شود.)
- انجام تست لیگاند «رادیولیبل» (Radiolabeled Ligand) یا تست «رادیوایمنی» (Radioimmunoassay | RIA)
مسدود کردن گروههای غیرواکنشی
بعد از اتصال لیگاند به ماتریکس، لیگاندهای اضافی متصل نشده باید شسته شوند و همچنین گروههایی از ماتریکس که به لیگاند متصل نشدهاند نیز باید مسدود شوند. چون این گروهها احتمال اتصال غیراختصاصی را افزایش میدهند.
برای مسدود کردن این گروهها از واکنشدهندههایی که بار مخالف دارند یا میتوانند به صورت کووالانسی به گروهها متصل شوند، استفاده میکنند. برای مثال وقتی از گروه کربوکسیل () برای اتصال لیگاند استفاده میشود، از تریس یا محلول اتانولامین (0٫1 تا 1 مولار) به عنوان محلول مسدود کننده استفاده میشود.
برای اطمینان از مسدود شدن تمامی گروههای غیرواکنشی میزان غلظت محلول مسدودکننده باید بیش از غلظت تمام مولکولهای واکنشدهنده روی سطح ماتریکس باشد. معمولا 5 تا 10 برابر بیش از غلظت لیگاند مناسب است.
محلول مسدودکننده باید pH مناسبی داشته باشد. pHهای خیلی بالا یا خیلی پایین مسدود کردن کامل گروههای غیرواکنشی را با مشکل روبرو میکند. همچنین ممکن است ماتریکس یا اتصال لیگاند به ماتریکس را تخریب کند.
فرایند مسدود کردن را میتوان در دمای اتاق به مدت 2 تا 4 ساعت انجام داد اما در دمای سرد (4 درجه سانتیگراد) به مدت زمان بیشتری احتیاج است. پس از اتمام فرایند مسدود کردن، ستون شسته میشود تا محلول مسدودکننده اضافی خارج شود.
سرعت جریان
سرعت جریانهای متفاوتی در مراحل مختلف کروماتوگرافی میل ترکیبی برای عبور دادن فاز متحرک از ستون استفاده میشود. سرعت جریانی که معمولا برای عبور نمونه از ستون استفاده میشود حدود 10 cm/hr است. محاسبه میزان سرعت جریان به عواملی زیر بستگی دارد.
- دما
- غلظت
- ثابت جداسازی (): غلظتی از لیگاند که نیمی از لیگاندها در آن به پروتئین اتصال دارند.
اگر پروتئین تمایل زیادی برای اتصال به لیگاند داشته باشد ()، سرعت جریان میتواند زیاد باشد. ولی اگر تمایل پروتئین برای اتصال به لیگاند کم باشد باید از سرعت کمتری استفاده کرد.
در مراحله شستشو میتوان سرعت جریان را بالا برد و به حدود 20 تا 50 cm/hr رساند. چون در این مرحله اتصالات غیراختصاصی که مدنظر کاربر نیست از ستون جدا میشوند. در صورتی که پروتئین هدف اتصال محکمی با لیگاند برقرار نمیکرد بهتر است که در مرحله شستشو نیز از سرعت جریان کم استفاده کرد.
سرعت جریانی که برای مرحله جداسازی مولکول هدف از لیگاند استفاده میشود، معمولا به اندازه سرعت جریان در مرحله شستشو است. میزان جریان نباید از جریان در مرحله متراکم سازی ماتریکسهای ستون بیشتر باشد.
در مرحله متعادلسازی نیز میتوان برای صرفهجویی در زمان از سرعت جریان بالا استفاده کرد. میزان سرعت جریان این مرحله نیز نباید از جریان در مرحله متراکم سازی ماتریکسهای ستون بیشتر باشد.
اتصالات غیراختصاصی
برای جلوگیری از اتصالات غیر اختصاصی بین مولکولهای غیرهدف و لیگاند، میتوان از محلول نمکی با غلظت بین 0٫1 تا 0٫5 مولار استفاده کرد. این میزان از محلول نمکی آنقدر زیاد نیست که باعث پیوندهای آبگریز بین پروتئین و ماتریکس یا لیگاند شود.
روش دیگر افزودن موادی مثل گلیسرول (تا غلظت 10٪) است. افزودن مقدار کمی از دترجنتها نیز پیوندهای غیراختصاصی را کاهش میدهد. البته در میزان استفاده از شویندهها باید دقت کرد چون ممکن است در اتصال لیگاند به مولکول هدف اختلال ایجاد کنند.
برای مثال برخی از شویندهها لیگاند را از ماتریکس جدا میکنند، آنها را دناتوره میکنند یا جایگاه فعال آنها را تغییر میدهند. در این صورت مولکول هدف نمیتواند به لیگاند متصل و از سایر مولکولها جدا شود.
بافر شوینده اختصاصی و غیراختصاصی
استفاده از بافر شوینده اختصاصی برای جدا کردن پروتئین هدف از لیگاند یکی از بهترین روشها است. در این روش در نتیجه رقابت بافر شوینده با پروتئین هدف بر سر اتصال به لیگاند ایجاد میشود.
| وضعیت | بافر |
| pH |
100 mM گلایسین-HCL در pH 2٫5 تا 3 100 mM سیتریک اسید در pH: 3 50 تا 100 mM تریتیلامین یا تریتانولامین در pH: 11٫5 150 mM آمونیوم هیدروکسید در pH: 10٫5 |
| قدرت یونی |
3٫۵ تا 4 مولار منیزیمکلرید در pH: 7 در 10 mM تریس 5 مولار لیتیومکلرید در بافر فسفات 10 mM در pH: 7٫۲ |
| دناتوره کردن |
6-2 mM گوانیدین.HCL ۸-2 mM اوره 1٪ داکسیکولات 1٪ SDS |
| آلی |
10٪ دیاکسان 50٪ اتیلنگلایکول در pH بین 8 تا 11٫۵ |
| رقیب اختصاصی | بیش از 0٫1 مولار از لیگاند رقابتی |
برای این کار از بافری استفاده میشود که تمایل بیشتری برای اتصال به لیگاند نسبت به پروتئین هدف داشته باشد. در این حالت مولکولهای داخل بافر پروتئین را از جای خود بلند میکنند و به لیگاند متصل میشوند. برای مثال α-متیل گلوکوزید یک بافر شوینده اختصاصی برای جدا کردن نمونه از لیگاند «کانکاوالین» (Concanavalin A) است.
اگر هیچ مولکول شوینده اختصاصی برای لیگاند وجود نداشته باشد از بافرهای شوینده غیراختصاصی استفاده میشود. مثالهایی از این بافرها در بخش زیر آمده است.
- استفاده از شیب غلظت نمک
- تغییر pH
- تغییر دما
جدول زیر نمونههایی از بافر جداسازی برای لیگاندهای خاص را نشان میدهد.
| لیگاند | بافر جدا کننده | ویژگی |
| پروتئین A |
استیک اسید گلایسین | غیر اختصاصی |
| ConA |
D-متیل گلیکوزید بافر بورات |
اختصاصی غیراختصاصی |
| لایزین |
دما نمک | غیراختصاصی |
| ژلاتین |
آرژینین pH |
اختصاصی غیراختصاصی |
| AMP |
، نمک |
اختصاصی غیراختصاصی |
حل مشکلات کروماتوگرافی میل ترکیبی
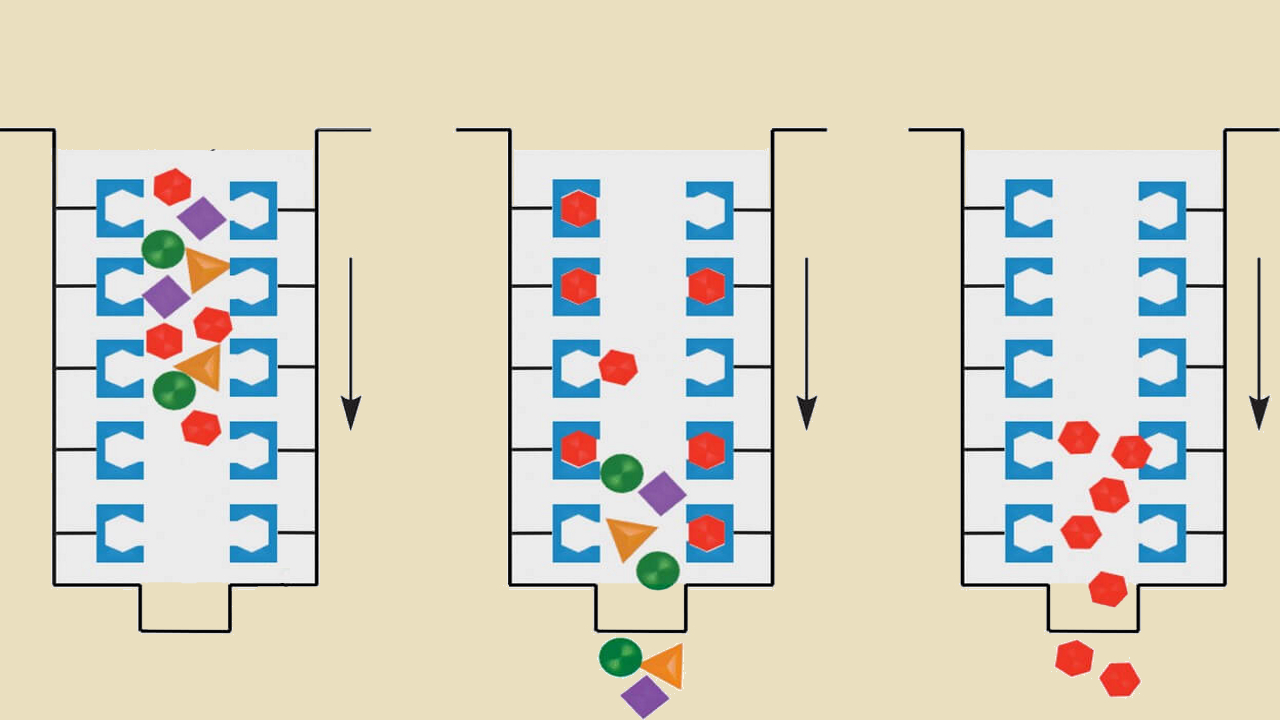
در این بخش مشکلات عملی که در حین انجام کروماتوگرافی میل ترکیبی اتفاق بیافتد بررسی و راه حل احتمالی برای آن ارائه میشود. نمودار زیر یک پاسخ رضایتبخش از تفکیک مولکول هدف را نشان میدهد.
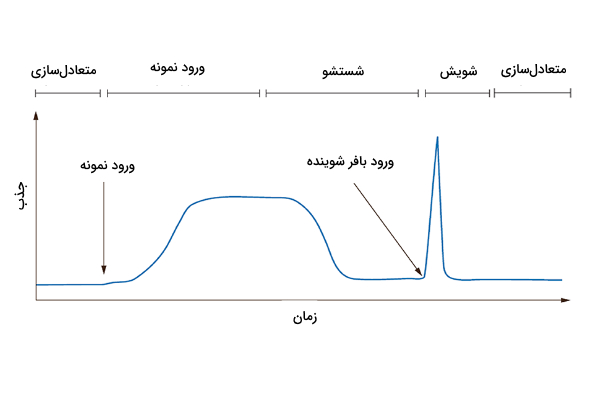
پیک تیز مولکول هدف در کروماتوگرافی میل ترکیبی نشانه چیست ؟
در این حالت معمولا فعالیت زیستی مولکول هدف با مشکل روبرو میشود. برای حل آن باید یا از نوع دیگری لیگاند استفاده کرد یا شرایط جدا کردن مولکول هدف از لیگاند را تغییر داد.
اگر از محلول شوینده با pH پایین برای جداکردن مولکول هدف از لیگاند استفاده میکنید باید نمونههای خارج شده از ستون را بالافاصه در بافر خنثیسازی بریزید.
بافر خنثیسازی از 20 تا 200 میکرولیتر تریس-HCL (1 مولار) با pH در حدود 9 در هر میلیلیتر از نمونه خارج شده از ستون تشکیل میشود.
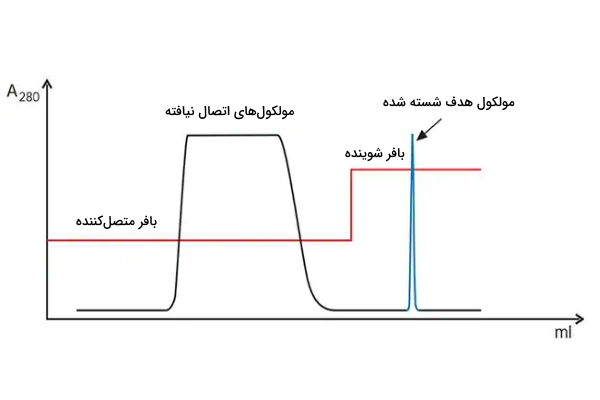
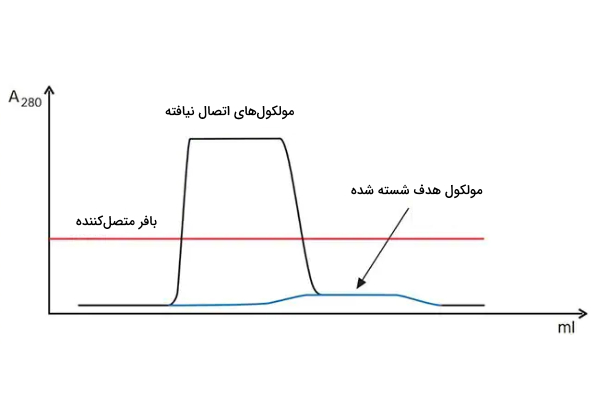
پیک پهن و کم ارتفاع مولکول هدف در کروماتوگرافی میل ترکیبی نشانه چیست ؟
مشکلی که نمودار زیر دارد پیک مولکول هدف پهن و همچنین خارج شدن آن در هنگام استفاده از بافر اتصال است. برای حل این مشکل باید شرایط اتصال را بهبود بخشید.
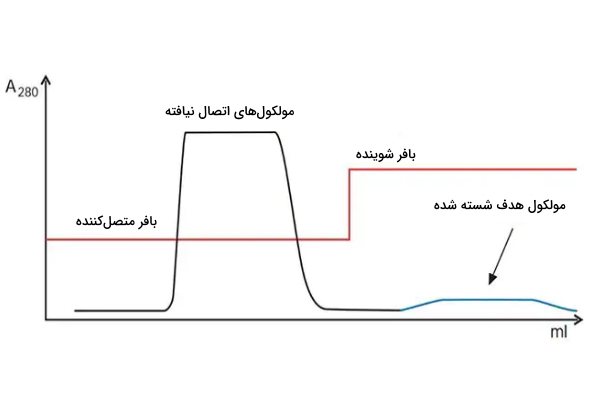
پیک پهن یا کوتاه مولکول هدف در کروماتوگرافی میل ترکیبی نشانه چیست ؟
تفاوت این حالت با حالت قبلی زمان آزاد بیرون آمدن مولکول هدف از ستون است. در حالت قبلی مولکول هدف قبل از ورود محلول جدا کننده از لیگاند جدا شده بود ولی در این نمودار در زمان درستی خارج شده هر چند که پیک مورد نظر کوتاه یا پهن است.
برای حل این مشکل راهکارهای زیر پیشنهاد میشود.
- شرایط جداشدن مولکول هدف از لیگاند را تغییر دهید.
- اگر از شوینده رقابتی استفاده میکنید، غلظت آن را افزایش دهید.
- اعمال فشار مداوم در مرحله جداشدن را قطع کنید تا مولکولها زمان لازم برای جداشدن از لیگاند داشته باشد.
این نتیجه ممکن از در اثر دناتوره شدن مولکول هدف و تجمع آن در ستون اتفاق بیافتد یا ممکن است به دلیل وجود اتصالات غیراختصاصی باشد.
جمعبندی
در کروماتوگرافی میلترکیبی با اتصال مولکول هدف به لیگاند خود میتوان آن را از سایر مولکولهای موجود در نمونه جدا کرد. در این روش آزمایشگاهی از بافرهای مختلفی استفاده میشود که بعضی از آنها به اتصال نمونه به لیگاند خود کمک میکنند و بعضی دیگر بعد از جداسازی سایر مولکولها از مولکول هدف، آن را از لیگاند خود جدا میکنند. عوامل مختلفی در بهینه کردن جداسازی مولکول هدف در این روش وجود دارد که انتخاب لیگاند مناسب، اتصال خوب لیگاند به ماتریکس، نوع بافرهای مورد استفاده و غیره از جمله آنها هستند.